Азот является химическим элементом с атомным номером 7 и химическим символом N. Он встречается в виде бесцветного газа без запаха и вкуса, с низкими температурами плавления и кипения. Узнайте об электронном строении азота, его физических и химических свойствах, а также его применении в промышленности и сельском хозяйстве.
Cодержание
Электронное строение азота
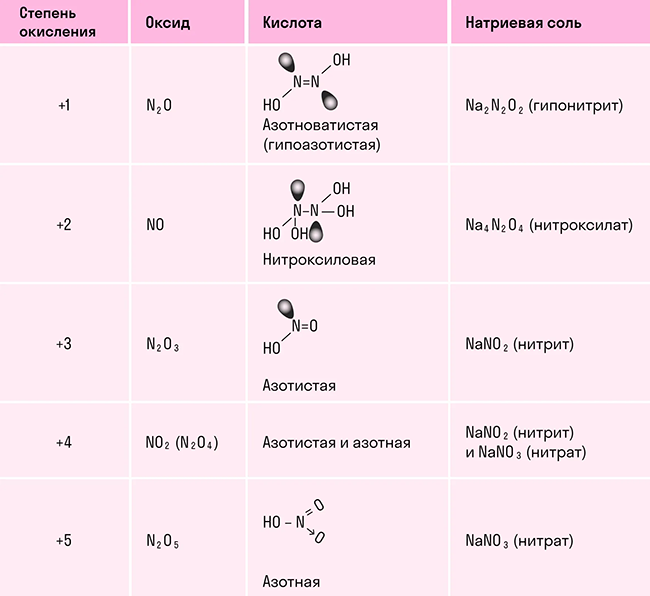
Азот (N) является химическим элементом с атомным номером 7 и химическим символом N. В его атоме содержится 7 протонов и 7 электронов. Электронная конфигурация азота в основном состоянии - 1s2 2s2 2p3, а в сокращенной форме - [He]2s2 2p3. На внешнем энергетическом уровне азот имеет 5 валентных электронов, включая 3 неспаренных п-электрона. Это позволяет азоту образовывать 3 связи по обменному механизму и еще одну связь по донорно-акцепторному механизму. Максимальная валентность азота составляет 4, так как на втором подуровне азота больше нет свободных орбиталей для распаривания электронов.

Строение молекулы азота
Молекула азота (N2) является двухатомной молекулой, где два атома азота связаны между собой прочной тройной связью. Эта тройная связь состоит из одной сигма-связи и двух пи-связей. Длина связи в молекуле азота составляет около 0,110 нм.

Физические свойства азота
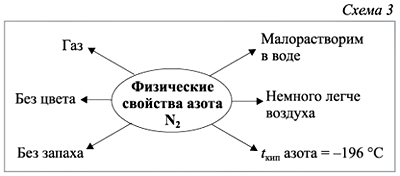
Азот в виде простого вещества является бесцветным газом без запаха и вкуса. Он малорастворим в воде и не ядовит. Плотность азота зависит от температуры и давления, при стандартных условиях (температура 0°C, давление 1 атмосфера) плотность азота составляет около 1,251 г/литр.
У азота низкие температуры плавления и кипения. Температура плавления азота составляет -209,86°C, а температура кипения -196°C. Азот не образует аллотропных модификаций.
Азот обладает двумя степенями свободы в газообразном состоянии, что определяет его движение в трехмерном пространстве.
См. также
Химические свойства азота
Азот является химически малоактивным элементом из-за прочной тройной связи между атомами в молекуле. Он вступает в химические реакции только при высоких температурах.
С металлами азот реагирует при нагревании, образуя нитриды. Например, с литием азот образует нитрид лития:
| Реакция | Уравнение |
|---|---|
| Азот + Литий | 6Li + N2 → 2Li3N |
С водородом азот реагирует только при высоком давлении, повышенной температуре и в присутствии катализатора, образуя аммиак:
| Реакция | Уравнение |
|---|---|
| Азот + Водород | N2 + 3H2 ⇌ 2NH3 |
Азот также проявляет окислительные свойства в реакциях с металлами и водородом, а восстановительные свойства - в реакциях с кислородом.
Азот играет важную роль в промышленности и сельском хозяйстве. Он используется для получения аммиака и азотных удобрений. Азот также применяется для создания инертной среды в химических реакциях и охлаждения в научных исследованиях.
Вывод
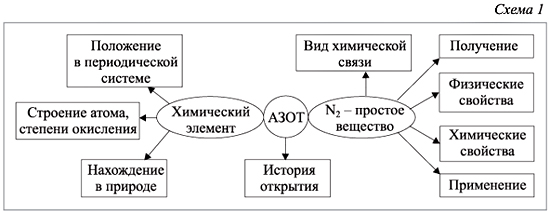
Азот - химический элемент с уникальными физическими и химическими свойствами. Он является бесцветным газом, малоактивным из-за прочной тройной связи, образующейся между атомами в молекуле. Азот обладает низкими температурами плавления и кипения, а его электронное строение и валентность определяют его способность к образованию связей. Химические свойства азота проявляются в его реакциях с металлами, водородом и кислородом, что делает его важным элементом в промышленности, сельском хозяйстве и научных исследованиях.
Что нам скажет Википедия?
Азот - химический элемент с атомным номером 7, простое вещество азот представляет собой двухатомный газ без цвета, вкуса и запаха. Он является одним из самых распространенных элементов на Земле и составляет 78% объема атмосферы. Азот химически инертен, но реагирует с комплексными соединениями переходных металлов. В промышленности, он применяется в качестве инертной среды и хладагента. Азот также является одним из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
История открытия азота связана с работами Генри Кавендиша, который в 1772 году провел опыты и выделил азот. Он назвал его удушливым воздухом. Джозеф Пристли и Даниэль Резерфорд также проводили эксперименты и выделили азот, но не смогли понять его природу как нового химического элемента. В 1787 году Антуан Лавуазье предложил название азот для этого элемента, основываясь на его свойстве не поддерживать горение и дыхание. Название азот сохранилось во французском и русском языках.
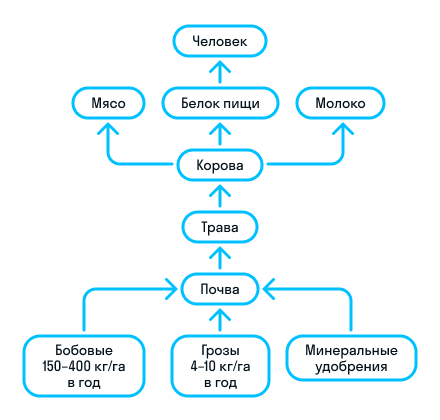
Азот широко распространен в природе и входит в состав белков, аминокислот, нуклеиновых кислот и других важных органических соединений. Он необходим для животных, растений и других живых организмов. Круговорот азота в природе может происходить как абиотическим путем, включающим окисление азота молнией и фиксацию атмосферного азота, так и биотическим путем, при котором азот фиксируется живыми организмами.