Азот (N2) является первым представителем V группы главной подгруппы и 2 периода периодической системы химических элементов. Узнайте об электронном строении, молекулярной структуре и химических свойствах азота. - NOCFN
Cодержание
Электронное строение азота
Азот (N2) является первым представителем V группы главной подгруппы и 2 периода периодической системы химических элементов. Он занимает лидирующее место в 15 группе длиннопериодной таблицы Менделеева. Атомный номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса азота составляет 14,00728 г/моль, а количество нейтронов в атоме равно семи.
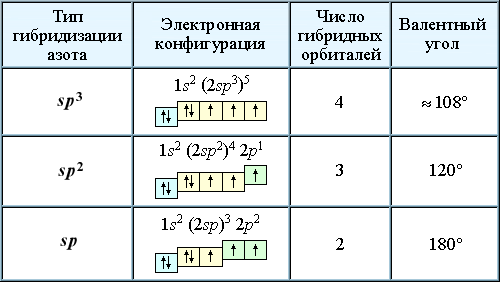
Электронная конфигурация азота в основном состоянии представляет собой формулу 1s2 2s2 2p3 или в сокращенном виде [He]2s2 2p3. На внешнем энергетическом уровне азот имеет 5 валентных электронов, из которых 3 являются неспаренными p-электронами.
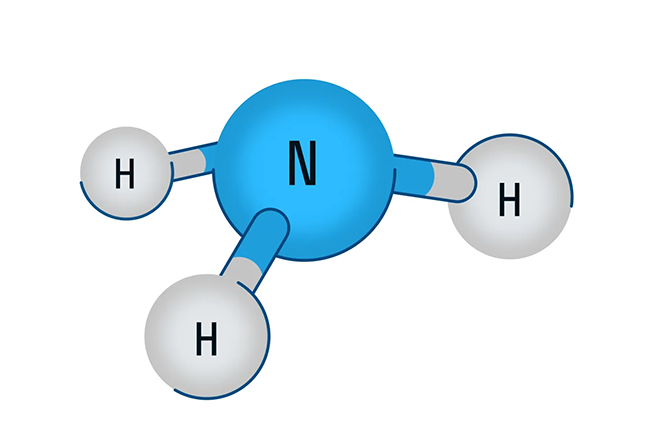
Строение молекулы азота
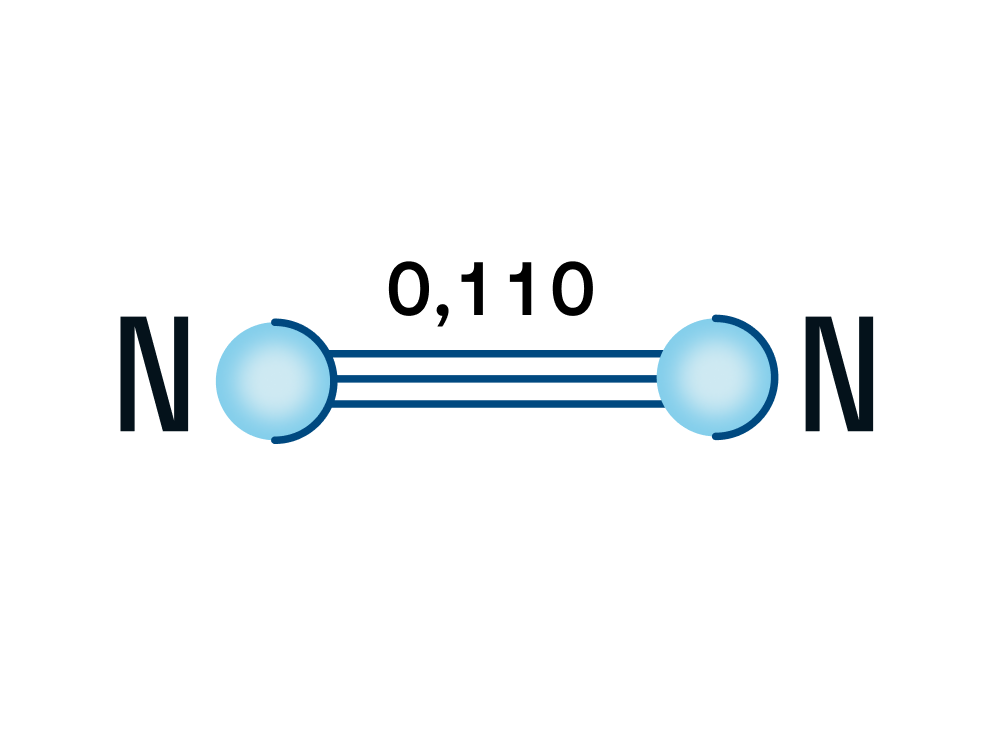
Молекула азота (N2) является двухатомной и атомы в ней связаны прочной тройной связью. Длина связи составляет 0,110 нм.
Тройная связь образуется благодаря трем неспаренным электронам у каждого атома азота. Она состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот является бесцветным газом без запаха, плохо растворяющимся в воде. По своей молярной массе азот легче, чем воздух. Он обладает низкими температурами кипения и плавления: температура плавления составляет -210 °C, а температура кипения -196 °C. Аллотропных модификаций азот не имеет.
См. также
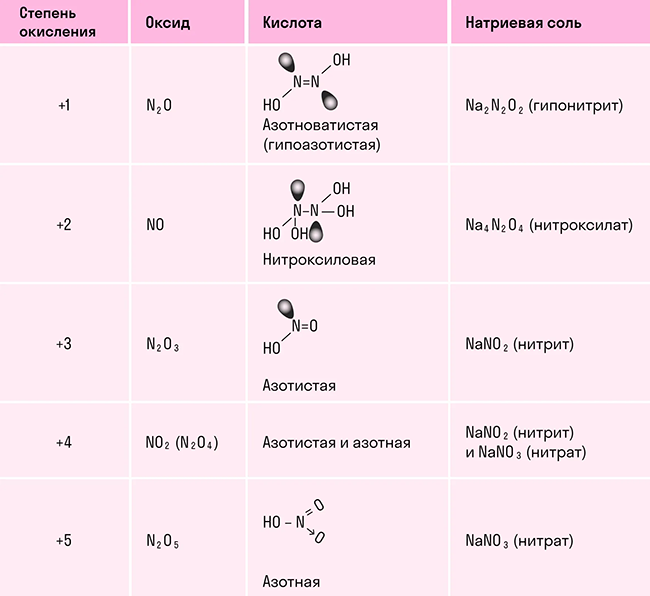
Химические свойства азота
Азот является химически малоактивным элементом из-за прочной тройной связи между атомами. Он может вступать в химические реакции только при высоких температурах. Азот проявляет степени окисления от -3 до +5.
Азот может образовывать связи по обменному механизму и донорно-акцепторному механизму. Молекула азота может реагировать с металлами, водородом, кислородом и другими элементами, образуя соответствующие соединения.

Применение азота
Азот имеет широкое применение в промышленности. Он используется для получения аммиака и азотных удобрений. Азот также применяется для создания инертной среды при химических реакциях и охлаждения в медицине и научных исследованиях.
Кроме того, азот входит в состав белков и нуклеиновых кислот, что делает его жизненно важным элементом для живых организмов.
Таким образом, азот имеет особое строение, химические и физические свойства, которые определяют его роль и применение в различных областях жизни.