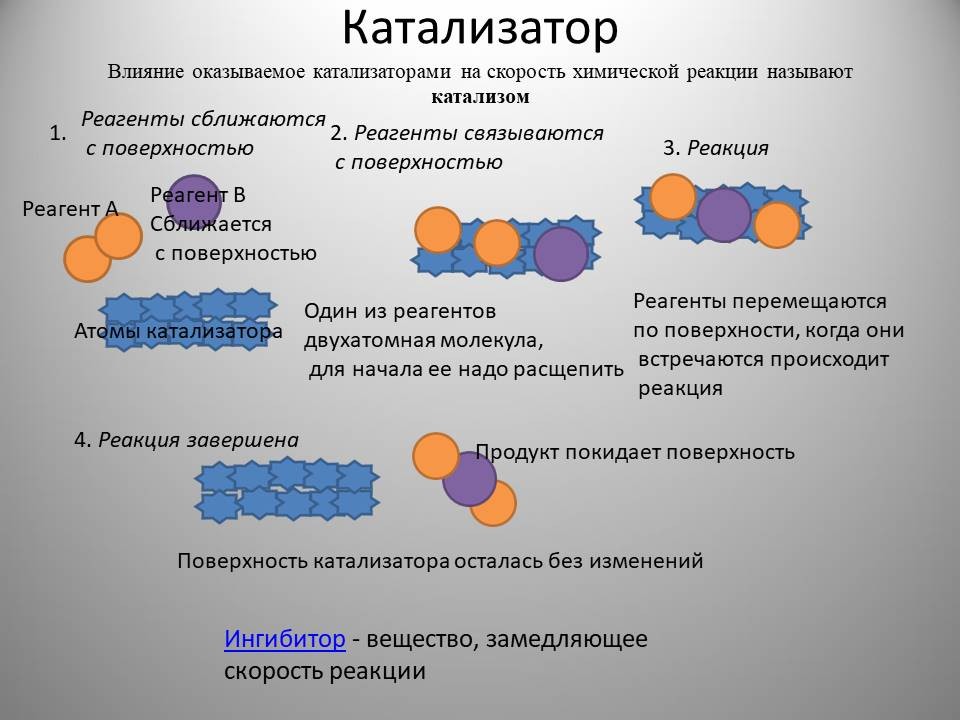
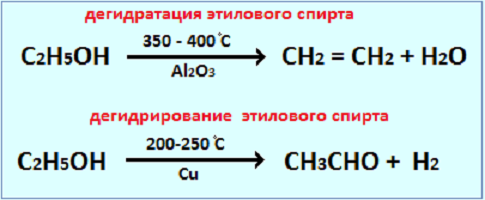
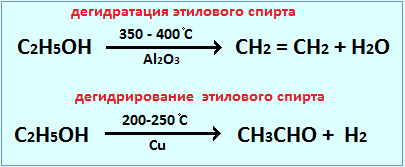
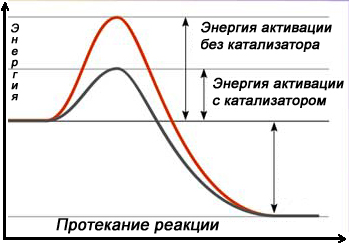
Катализатор – химическое вещество, которое ускоряет реакцию, не расходуясь в процессе. Он играет важную роль в химических реакциях, позволяя им протекать при более низких температурах или с большей скоростью. Узнайте, как понять, что вещество является катализатором, и изучите различные типы катализаторов и их применение в разных областях. NOCFN
Cодержание
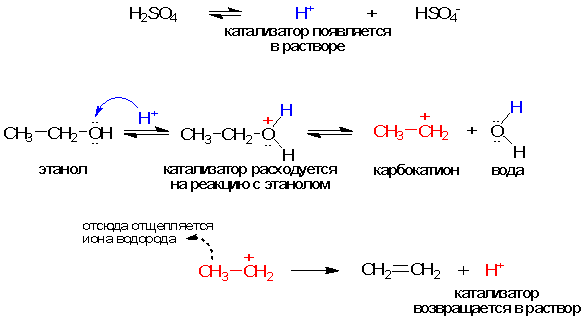
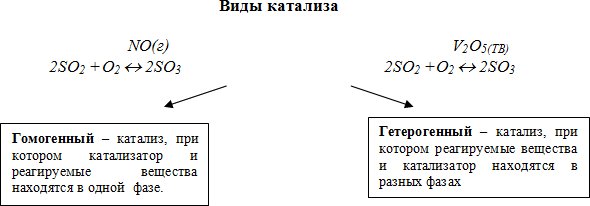
Катализатор - химическое вещество, которое ускоряет реакцию, не расходуясь в процессе. Он играет важную роль в химических реакциях, позволяя им протекать при более низких температурах или с большей скоростью. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенные катализаторы находятся в одной фазе с реагирующими веществами, а гетерогенные образуют самостоятельную фазу, отделенную границей раздела.
Гомогенные и гетерогенные катализаторы
Типичными гомогенными катализаторами являются кислоты и основания. Они находятся в растворе вместе с реагирующими веществами. Гетерогенные катализаторы, напротив, применяются в форме твердых веществ, таких как металлы, их оксиды и сульфиды. Эти катализаторы образуют отдельную фазу, отделенную от фазы реагирующих веществ.
Гетерогенные катализаторы обычно имеют сильно развитую поверхность. Они могут быть распределены на инертном носителе, таком как силикагель, оксид алюминия или активированный уголь. Это позволяет увеличить площадь соприкосновения катализатора с реагентами, что обеспечивает более эффективную реакцию.
Различные типы катализаторов
Для каждого типа реакций существуют определенные эффективные катализаторы. Помимо кислотно-основных катализаторов, существуют катализаторы окисления-восстановления. Они содержат переходные металлы или их соединения, которые изменяют степень окисления металла для осуществления катализа.
Координационные катализаторы действуют через координацию реагентов у атома или иона переходного металла. Примерами таких катализаторов являются титан, родий и никель.
Если катализатор обладает хиральными свойствами, то он может превратить оптически неактивные субстраты в оптически активные продукты.
В некоторых случаях используются системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции. Также возможно явление "катализа катализа", когда один катализатор увеличивает скорость стадии, осуществляемой другим катализатором.
См. также
Катализаторы в автомобильных выхлопных системах
Автомобильные выхлопные системы оснащены специальным фильтром - каталитическим нейтрализатором выхлопных газов, или просто катализатором. Его задача - снизить уровень углеводородов, оксида углерода и оксида азота в выхлопных газах, чтобы уменьшить вредные выбросы и защитить окружающую среду.
Катализатор в выхлопной системе представляет собой утолщенную стальную трубу, установленную между выходным коллектором и глушителем. Внутри катализатора находятся ценные металлы, такие как платина, палладий, родий или иридий, которые ускоряют химическую реакцию доокисления токсичных веществ в выхлопных газах.
Катализатор работает путем разложения токсичных компонентов выхлопов на безопасные составляющие. Для максимальной эффективности площадь соприкосновения газов и катализатора максимальна, поэтому используется мелкоячеистая пористая структура монолита внутри катализатора.
Неисправности катализатора
По мере эксплуатации автомобиля катализатор может выйти из строя. Хотя производители обычно указывают рабочий ресурс катализатора в пределах 120-150 тысяч километров, на практике срок его службы может быть гораздо меньше.
Симптомы забитости или неисправности катализатора могут включать:
- Повышенный расход топлива.
- Потерю мощности двигателя.
- Появление аномальных запахов в выхлопных газах.
- Появление ошибок в системе управления двигателем.
Если вы замечаете подобные симптомы, рекомендуется обратиться к специалистам для диагностики и замены катализатора при необходимости.
В заключение, катализатор - важное химическое вещество, которое ускоряет химические реакции, не расходуясь в процессе. Он играет ключевую роль в различных областях, от химической промышленности до автомобильных выхлопных систем. Правильное понимание и использование катализаторов позволяет нам эффективно проводить разнообразные химические реакции и снижать вредные выбросы в окружающую среду.
Что нам скажет Википедия?
Катализатор - химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный - образует самостоятельную фазу, отделенную границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Для каждого типа реакций эффективны только определенные катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путем изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен, так как противоречит закону сохранения энергии: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдет по более быстрому, в данном случае, не катализированному, пути.