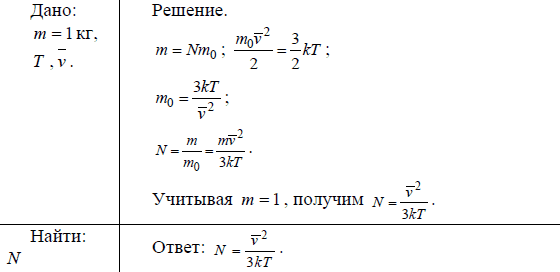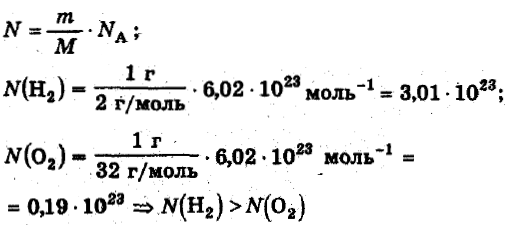Число Авогадро, также известное как постоянная Авогадро или константа Авогадро, является физической величиной, которая определяет количество специфицированных структурных единиц, таких как атомы, молекулы, ионы, электроны или другие частицы, в одном моле вещества. Узнайте подробности о числе молекул и его роли в физике и химии на NOCFN.
Cодержание
Введение
Число́ Авога́дро, также известное как постоянная Авогадро или константа Авогадро, является физической величиной, которая определяет количество специфицированных структурных единиц, таких как атомы, молекулы, ионы, электроны или другие частицы, в одном моле вещества. Оно ранее определялось как количество атомов в 12 граммах чистого изотопа углерода-12. Обозначается обычно как NA или L.

Постоянная Авогадро и моль
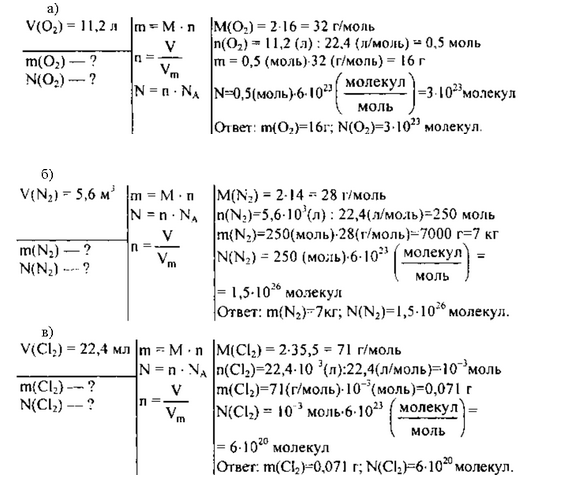
Моль является единицей измерения количества вещества в Международной системе единиц (СИ). Она определяется через число Авогадро, которое равно количеству частиц (атомов, молекул, ионов, электронов или других объектов) в одном моле вещества. Значение числа Авогадро составляет примерно 6,02214076⋅10^23 частиц.
Масса одного моля вещества, измеряемая в граммах (молярная масса), численно равна его молекулярной массе, выраженной в атомных единицах массы. Например, масса одного моля лития составляет 7 г/моль, а масса одного моля кислорода составляет 32 г/моль.
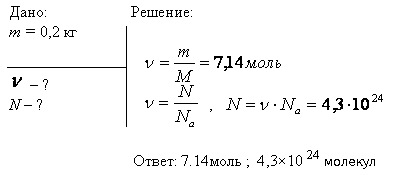
Закон Авогадро
Закон Авогадро утверждает, что при одинаковых температуре и давлении, в равных объемах идеальных газов содержится одинаковое количество молекул. Согласно этому закону, один моль любого газа при нормальных условиях занимает объем, равный примерно 22,4 литра, что называется молярным объемом газа.
См. также
История измерения константы Авогадро
Первая попытка определить число молекул в заданном объеме была предпринята в 1865 году Йозефом Лошмидтом, который получил значение, приближенное к истинному. Впоследствии, в 1873 году, Джеймс Клерк Максвелл дал более точную оценку, которая составляла около 19 миллионов миллиардов молекул в одном кубическом сантиметре воздуха.
На XXIV Генеральной конференции по мерам и весам, которая прошла в конце 2011 года, было принято предложение определить моль таким образом, чтобы избежать привязки к определению килограмма. В 2018 году моль была переопределена на основе числа Авогадро, которому было приписано точное значение без погрешности, основываясь на результатах измерений, рекомендованных CODATA. В 2015 году было получено рекомендованное значение числа Авогадро, которое составляет примерно 6,02214082(11)⋅10^23 моль^-1.

Заключение
Число молекул, известное как число Авогадро, является фундаментальной константой в физике и химии. Оно определяет количество частиц в одном моле вещества и играет важную роль при расчетах и измерениях в различных областях науки. Определение моля и числа Авогадро было уточнено в последние годы, что позволяет более точно и надежно использовать эти величины в научных и практических целях.

Что нам скажет Википедия?
Число́ Авога́дро, конста́нта Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Ранее определялось как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, а иногда и L.
Моль — количество вещества, которое содержит NA структурных элементов (то есть столько же, сколько атомов содержится в 12 г 12С, согласно старому определению), причём структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества (молярная масса), выраженная в граммах, численно равна его молекулярной массе, выраженной в атомных единицах массы.
В конце 2011 года на XXIV Генеральной конференции по мерам и весам единогласно принято предложение определить моль в будущей версии Международной системы единиц (СИ) таким образом, чтобы избежать его привязки к определению килограмма. Предполагалось, что моль в 2018 году будет определён на основе числа Авогадро, которому будет приписано точное значение без погрешности, базирующееся на результатах измерений, рекомендованных CODATA. До 20 мая 2019 года число Авогадро являлось измеряемой величиной, не принимаемой по определению. В 2015 году из наиболее прецизионных измерений получено рекомендованное значение числа Авогадро NA = 6,022 140 82(11)⋅1023 моль−1, полученное в результате усреднения результатов различных измерений.
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое количество молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объём, при нормальных условиях равный 22,41383 литра. Эта величина известна как молярный объём газа.
Сам Авогадро не делал оценок числа молекул в заданном объёме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объём, предпринял в 1865 году Йозеф Лошмидт. Из вычислений Лошмидта следовало, что для воздуха количество молекул на единицу объёма составляет 1,81⋅1018 см−3, что примерно в 15 раз меньше истинного значения. Через 8 лет Максвелл привёл гораздо более близкую к истине оценку «около 19 миллионов миллионов миллионов» молекул на кубический сантиметр, или 1,9⋅1019 см−3. По его оценке число Авогадро было приблизительно 1022.