Узнайте, сколько существует изотопов водорода и как они используются. Протий, дейтерий и тритий - различные варианты водорода с уникальными свойствами. Они играют важную роль в различных отраслях промышленности и науки, от производства энергии до создания оружия. Узнайте больше на NOCFN.
Cодержание
Водород (химический символ — H, от лат. hydrogenium) — химический элемент первого периода периодической таблицы химических элементов Д. И. Менделеева, с атомным номером 1.
Одноатомная форма водорода — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы. Самый лёгкий из элементов периодической таблицы.
Изотопы водорода
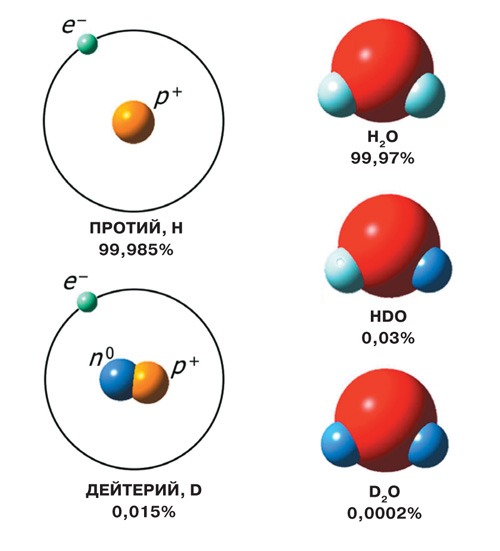
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа — протия — состоит из одного только протона и не содержит нейтронов.
Изотопы — это варианты данного элемента, имеющие в своем ядре разное количество нейтронов. В случае водорода, его изотопы имеют массовые числа 1, 2 и 3. Протий, или 1H, является наиболее распространенным изотопом водорода. Дейтерий, или 2H, имеет один нейтрон в своем ядре, в то время как тритий, или 3H, является радиоактивным и имеет два нейтрона.
Свойства и использование водорода
При стандартной температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ (химическая формула — H2), который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. Водород также может быть растворим в этаноле и некоторых металлах, таких как железо, никель, палладий, титан, платина и ниобий.
Водород играет особенно важную роль в кислотно-основных реакциях и используется в различных отраслях промышленности, включая производство аммиака, очистку металлов, производство плавикового газа и водородных топливных элементов.
История открытия и названия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород.
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой, "горючим воздухом".
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье в 1783 году осуществил синтез воды и установил, что "горючий воздух" входит в состав воды и может быть из неё получен.
Самые известные изотопы водорода — протий, дейтерий и тритий — были открыты в разное время. Дейтерий был открыт в 1931-1932 годах американским физикохимиком Гарольдом Юри, а тритий был открыт в 1934 году физиком Эрнестом Резерфордом и его коллегами.
Изотопы водорода, особенно дейтерий и тритий, имеют важное практическое применение в ядерной энергетике и создании термоядерного оружия.
Заключение
Водород является элементом с различными изотопами, включая протий, дейтерий и тритий. Каждый из этих изотопов имеет свои уникальные свойства и применения. Они играют важную роль в различных отраслях промышленности и науки, от производства энергии до создания оружия.