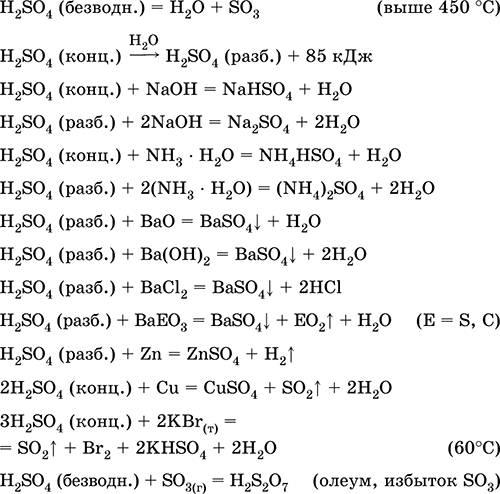Серная кислота (H2SO4) - сильная неорганическая кислота, обладающая высшей степенью окисления серы (+6). Узнайте о реакции различных металлов с серной кислотой, истории и методах получения. Будьте осторожны: она ядовита и обладает сильной коррозионной активностью.
Cодержание
Серная кислота (H2SO4) - сильная неорганическая кислота, обладающая высшей степенью окисления серы (+6). При обычных условиях концентрированная серная кислота представляет собой тяжелую маслянистую жидкость без цвета и запаха, с сильнокислым вкусом. Она является токсичной в больших дозах и обладает исключительно сильной коррозионной активностью.
Исторические сведения
Серная кислота известна с древности и встречается в природе в виде озер возле вулканов. Уже в древние времена алхимики, такие как арабский ученый Джабир ибн Хайян, упоминали о кислых газах, получаемых при прокаливании различных веществ. В IX веке персидский алхимик Ар-Рази и европейский алхимик Альберт Магнус разработали методы получения серной кислоты.
В XVI веке алхимик Василий Валентин описал способ получения серной кислоты путем поглощения газа (серного ангидрида) водой, который выделялся при сжигании смеси порошков серы и селитры. Этот метод стал основой для "камерного" способа получения серной кислоты, который использовался в небольших камерах, облицованных свинцом, вплоть до 1955 года.
Кроме того, в XV веке был известен способ получения серной кислоты из пирита (серного колчедана), который был более дешевым и распространенным сырьем, чем сера. Этот метод использовался в течение 300 лет и впоследствии был вытеснен камерным способом синтеза.
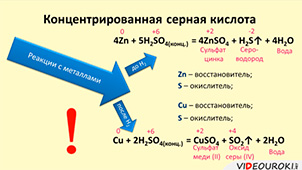
Взаимодействие серной кислоты с металлами
Серная кислота, особенно в концентрированной форме, способна реагировать с металлами в качестве окислителя. Обычно, когда металл взаимодействует с H2SO4, образуется сульфатная соль металла, а также выделяется газообразный водород.
Однако, есть металлы, такие как золото, которые не реагируют с серной кислотой. Кроме того, железо проявляет особое поведение в отношении серной кислоты. Оно будет атаковано разбавленной серной кислотой, но можно хранить высококонцентрированную серную кислоту и олеум в железных контейнерах, так как на поверхности железа образуется плотный слой сульфата, который защищает его от дальнейшего взаимодействия с кислотой.
Реакция с разбавленной серной кислотой
При взаимодействии разбавленной серной кислоты с активными металлами, такими как литий, калий, кальций, натрий, магний и др., происходит выделение водорода. Это связано с тем, что эти металлы находятся в ряду напряжений левее водорода.
Например, при добавлении разбавленной серной кислоты к цинку, наблюдается выделение пузырьков водорода:
| H2SO4 | Zn | ZnSO4 | H2 ↑ |
|---|---|---|---|
| Серная кислота | Цинк | Сульфат цинка | Водород |
Однако медь, которая стоит в ряду напряжений после водорода, не реагирует с разбавленной серной кислотой.
Реакция с концентрированной серной кислотой
Взаимодействие металлов с концентрированной серной кислотой протекает по-другому. Например, цинк, как активный металл, может образовывать сернистый газ, элементарную серу и даже сероводород при реакции с концентрированной серной кислотой:
2H2SO4 + Zn = SO2 ↑ + ZnSO4 + 2H2O
Медь, как менее активный металл, при взаимодействии с концентрированной серной кислотой восстанавливает ее до сернистого газа:
2H2SO4 конц. + Cu = SO2 ↑ + CuSO4 + 2H2O
Таким образом, в пробирках с концентрированной серной кислотой наблюдается выделение сернистого газа.
Техника безопасности
При работе с серной кислотой необходимо соблюдать правила безопасности. Сернистый газ ядовит, поэтому опыты следует проводить под тягой. Также необходимо использовать соответствующее оборудование, такое как пробирки и штативы для пробирок.