Узнайте, который из элементов - водород или азот - является менее электроотрицательным. Роль электроотрицательности в химических связях и ее влияние на образование полярных связей. Знание электроотрицательности элементов для понимания химических связей. Познавайте химию с NOCFN.
Cодержание
Электроотрицательность - это фундаментальное химическое свойство атома, которое определяет его способность притягивать электроны других атомов в молекуле. Это свойство играет важную роль в образовании химических связей и определении химической активности элементов.

Электроотрицательность и шкала Полинга
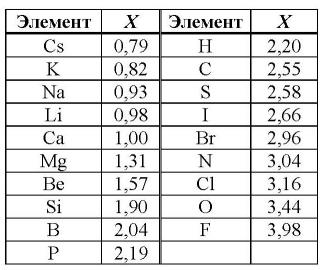
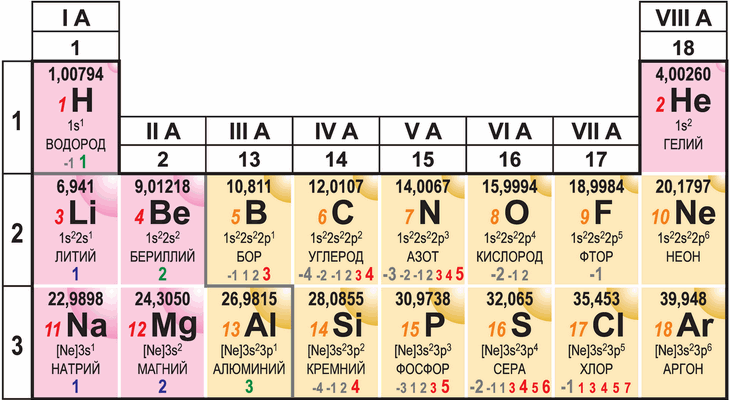
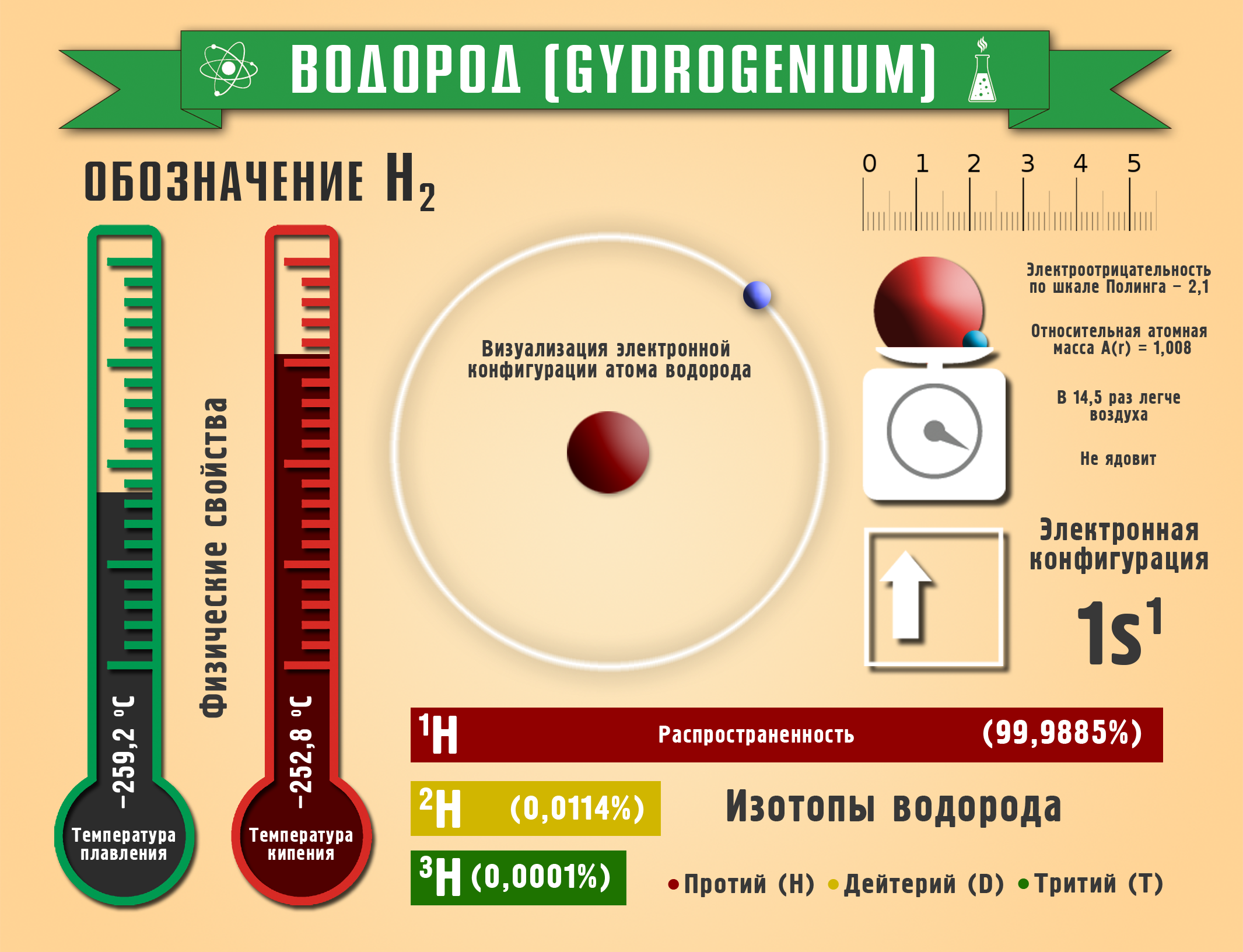
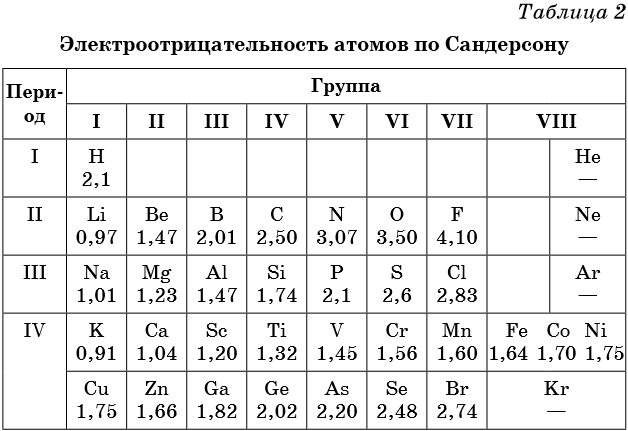
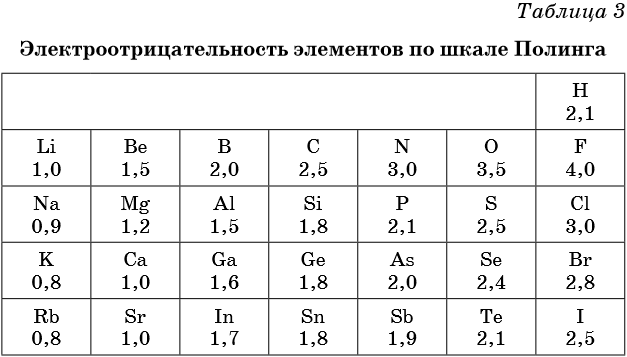
Самая известная и широко используемая шкала электроотрицательности разработана американским химиком Л. Полингом. На этой шкале значения электроотрицательности варьируются от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор считается наиболее электроотрицательным элементом, за ним следуют кислород, азот и хлор. Водород имеет электроотрицательность, равную 2,2.

Электроотрицательность водорода и азота
Исходя из данных шкалы Полинга, можно сделать вывод, что азот (электроотрицательность около 3,0) является более электроотрицательным элементом по сравнению с водородом (электроотрицательность 2,2). Это означает, что азот обладает большей способностью притягивать электроны, чем водород.
См. также
Роль электроотрицательности в химических связях
Электроотрицательность элементов играет важную роль в определении типа и силы химической связи между атомами. Когда атомы с разными электроотрицательностями образуют связь, электроны в большей мере притягиваются к атому с более высокой электроотрицательностью. Это приводит к образованию полярной связи.
В случае водорода и азота, азот обладает более высокой электроотрицательностью, поэтому в молекуле аммиака (NH3) электроны в большей степени притягиваются к азоту. Это приводит к образованию полярной связи между азотом и каждым из трех водородных атомов.

Вывод
Исходя из данных шкалы Полинга, азот является более электроотрицательным элементом по сравнению с водородом. Это свойство азота определяет его способность притягивать электроны в молекулах. Знание электроотрицательности элементов позволяет понять и прогнозировать тип и силу химических связей в различных соединениях.

Что нам скажет Википедия?
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности (полярности), силовую постоянную и т. д.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности (полярности), силовую постоянную и т. д.