Теория атома Бора объясняет стабильность атомов и дискретный характер атомных спектров. Узнайте, как модель Бора помогла понять структуру атома и его взаимодействие с электромагнитным излучением.
Cодержание
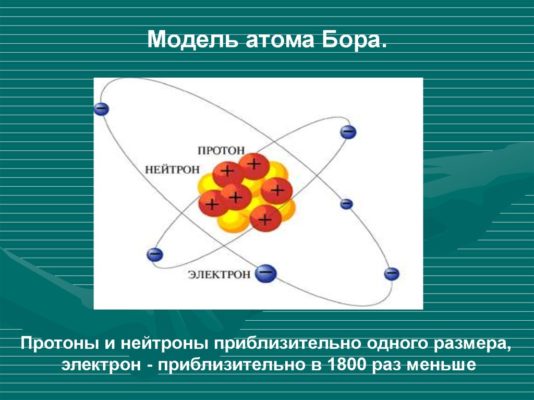
Модель Бора атома водорода
Теория атома Бора была разработана Нильсом Бором в начале XX века с целью объяснить структуру и поведение атомов. Основной постулат этой модели заключается в предположении о существовании стационарных состояний, в которых электроны могут находиться без излучения энергии. Это позволяет объяснить стабильность атомов и дискретный характер атомных спектров.
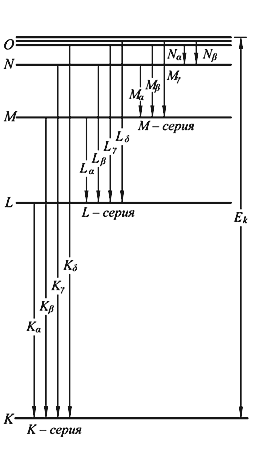
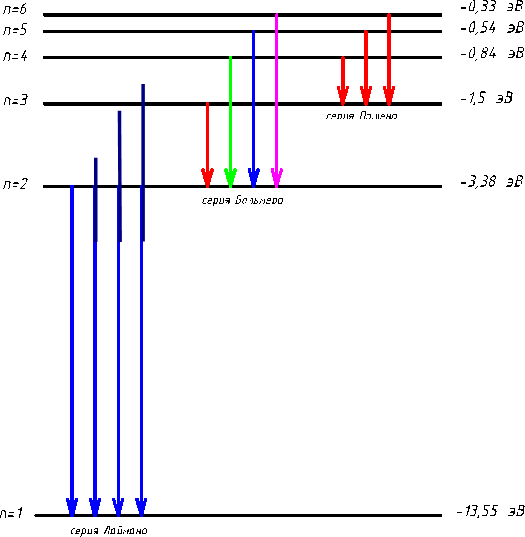
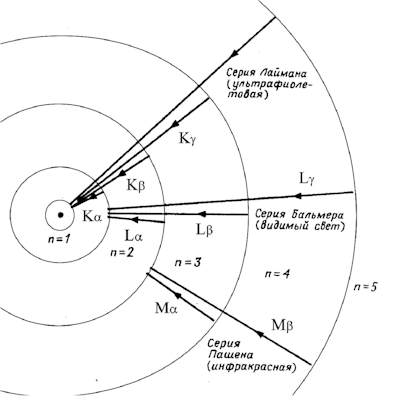
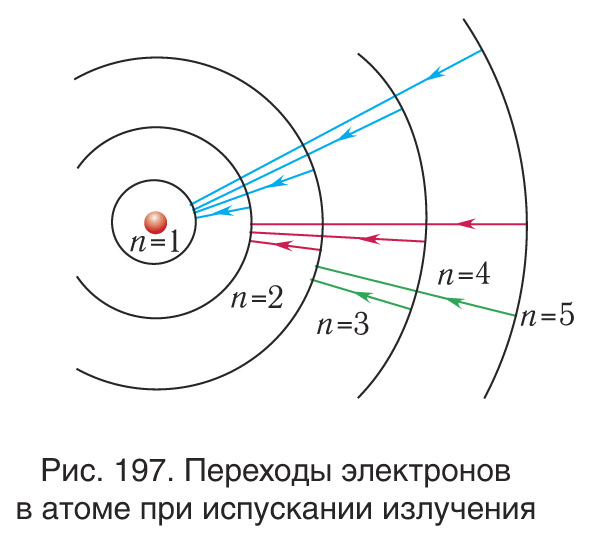
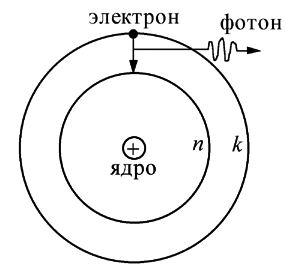
В модели Бора атома водорода электрон движется по круговой орбите вокруг положительно заряженного ядра. Известно, что стационарные орбиты существуют только при определенных значениях энергии. Переход электрона между орбитами происходит при поглощении или испускании кванта электромагнитной энергии.
Ключевые постулаты теории Бора:
- Движение электрона по орбите является круговым.
- Энергия электрона квантуется и определяется номером орбиты.
- Переход между орбитами сопровождается поглощением или испусканием кванта электромагнитной энергии.
Радиус первой орбиты в атоме водорода, известный как боровский радиус, составляет 0.529 Å. Энергия электрона на первой орбите равна -13.6 эВ. При переходе между орбитами происходит излучение или поглощение энергии, частота которого определяется разностью энергий в начальном и конечном состояниях.

Роль теории Бора в объяснении стабильности атомов
Теория Бора позволяет объяснить стабильность атомов. Согласно модели Бора, для каждого электрона в атоме существует орбита с наименьшей возможной энергией. Когда все электроны находятся на таких орбитах, атом не способен излучать энергию. Основное состояние атома, когда все электроны находятся на орбитах с наименьшей возможной энергией, является наиболее стабильным состоянием. Атом может находиться в основном состоянии сколь угодно долго.
Также модель Бора объясняет сходство атомов одного и того же химического элемента. Стационарные орбиты электронов во всех атомах данного элемента одни и те же, что приводит к схожим свойствам и химической активности.

Ограничения и современная квантовая механика
Теория атома Бора, хотя и позволяет объяснить некоторые особенности атомных спектров и стабильность атомов, имеет свои ограничения. Она основана на классической механике и не учитывает некоторые квантовые эффекты.
Современная квантовая механика разработана на основе более общих и непротиворечивых постулатов и предоставляет более полное описание атомной структуры и поведения частиц. Она использует волновые функции для описания вероятности обнаружения частицы в пространстве и операторы для описания физических величин.
Несмотря на замену теории Бора современной квантовой механикой, правила квантования, разработанные Нильсом Бором, все еще широко используются в научных и инженерных расчетах.
См. также
Заключение
Теория атома Бора играла важную роль в развитии физики и позволила объяснить стабильность атомов и дискретный характер атомных спектров. Стационарные орбиты электронов и квантование энергии помогли понять структуру атома и его взаимодействие с электромагнитным излучением.
Однако теория Бора имеет свои ограничения и была заменена современной квантовой механикой, которая обладает более общими и точными постулатами. В современной физике теория Бора остается важным историческим вехом и представляет собой основу для понимания квантовых явлений.
Что нам скажет Википедия?
Боровская модель атома, также известная как модель Бора или модель Бора — Резерфорда, является полуклассической моделью атома, предложенной Нильсом Бором в 1913 году. Она основана на планетарной модели атома, предложенной Эрнестом Резерфордом. Однако, согласно классической электродинамике, электрон, двигаясь вокруг ядра, должен непрерывно излучать энергию и, в результате, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввел допущение о стационарных орбитах, по которым электроны могут двигаться, не излучая энергию. Излучение или поглощение энергии происходит только при переходе между орбитами. Стационарными считаются только те орбиты, на которых момент количества движения электрона равен целому числу постоянных Планка.
Используя это допущение и законы классической механики, Бор получил значения радиуса стационарных орбит и энергии электрона на этих орбитах. Радиус первой орбиты в атоме водорода, называемый боровским радиусом или атомной единицей длины, составляет 5,2917720859(36)⋅10−11 метра. Энергия первой орбиты, обозначаемая как E0 и равная -13,6 эВ, представляет собой энергию ионизации атома водорода.
Теория Бора основана на двух постулатах Бора и применяется в качестве приближенных соотношений, описывающих структуру атомов. Однако она имеет свои недостатки и была заменена современной квантовой механикой, основанной на общих и непротиворечивых исходных положениях. Несмотря на это, правила квантования, разработанные Бором, все еще широко используются в настоящее время.
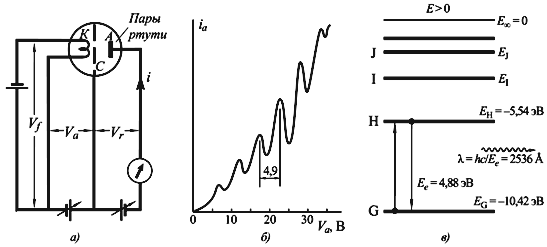
Эксперимент Франка-Герца, проведенный в 1914 году, косвенно подтвердил теорию Бора. В этом эксперименте атомы разреженного газа обстреливались медленными электронами, и распределение электронов по скоростям до и после столкновения исследовалось. Результаты этого опыта указывали на то, что атомы могут поглощать или излучать энергию только в количествах, равных разности энергий стационарных состояний.