Кислоты являются распространенными химическими соединениями и играют важную роль в современной химии. Узнайте, как определить сильные и слабые кислоты, их физические свойства и взаимодействие с основаниями. - NOCFN
Cодержание
Общие свойства кислот
Кислоты являются одним из наиболее распространенных видов химических соединений, наряду с основаниями, солями и металлами. Они играют важную роль в современной химии и получили свое название от средневековых алхимиков, которые пробовали вкус полученных веществ и заметили, что кислоты обладают кислым вкусом.
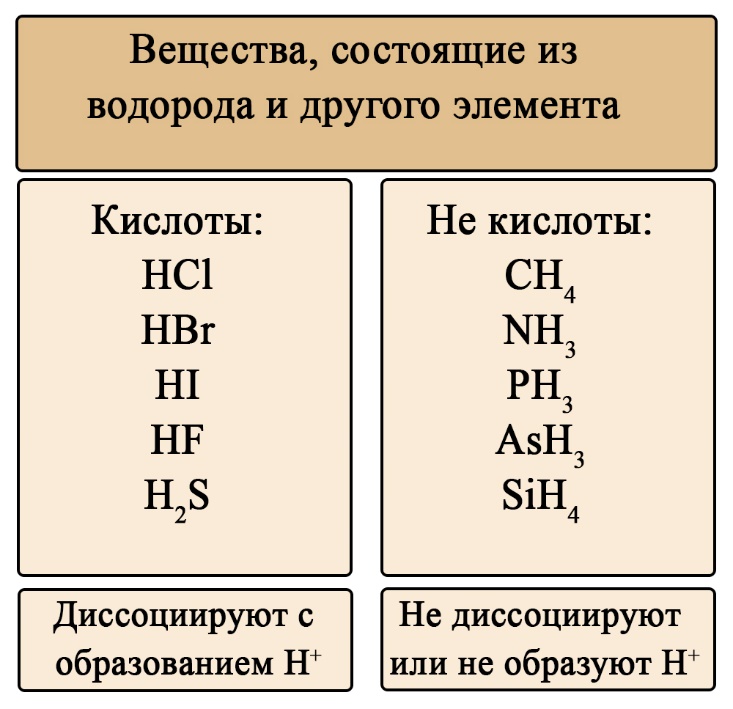
Все кислоты представляют собой сложные химические соединения, состоящие из нескольких химических элементов. Характерной чертой практически всех кислот является наличие атомов водорода (H). Кислоты состоят из водорода и кислотного остатка, например, серная кислота имеет формулу H2SO4. Однако, существуют исключения, такие как кислоты Льюиса, которые не содержат водорода, но могут принимать пару электронов соединения-донора.
Физические свойства кислот могут варьироваться. Все кислоты обладают кислым или металлическим вкусом, но их цвет, запах и агрегатное состояние могут различаться. Кислоты могут находиться в твердом, жидком или газообразном состоянии.
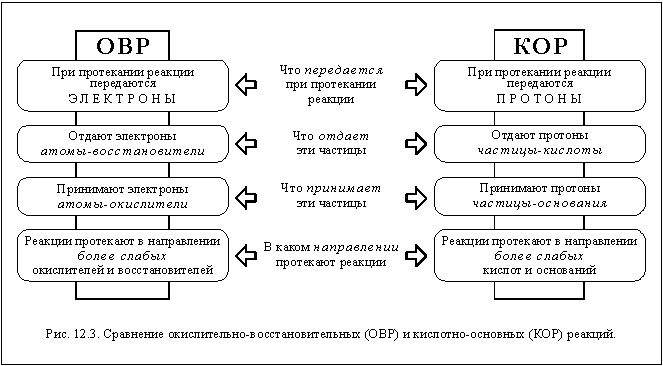
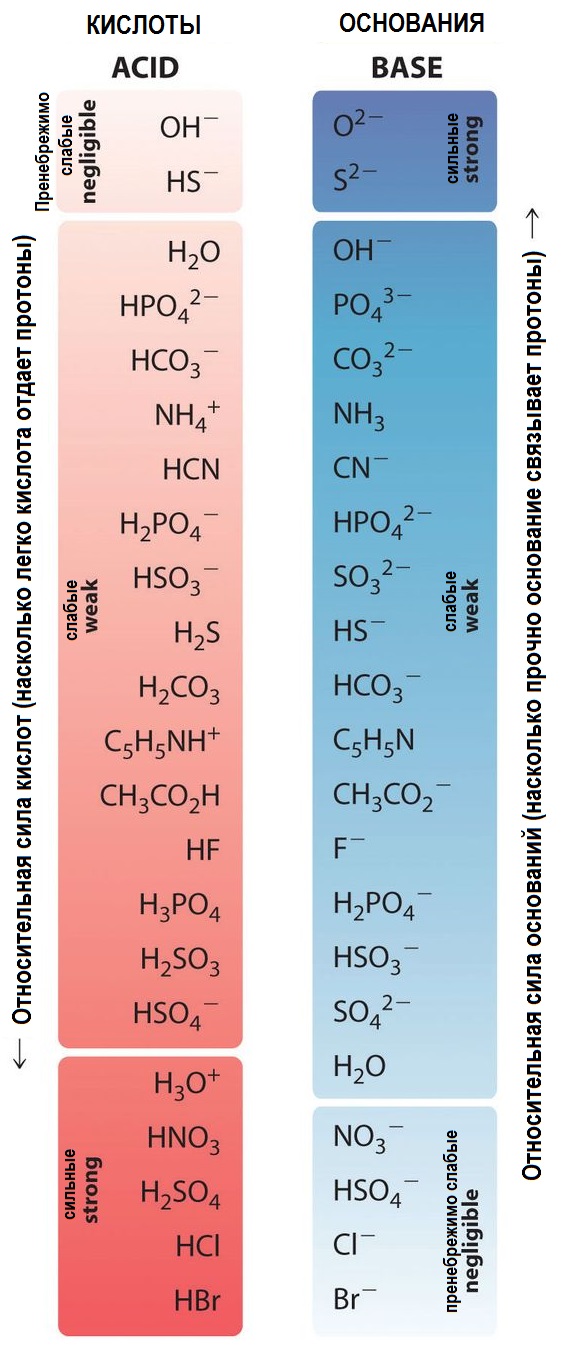
В химии кислоты классифицируются согласно различным теориям. Согласно теории Аррениуса, кислоты - это вещества, диссоциирующие в растворах с образованием катионов водорода. По теории Льюиса, кислота - это соединение или ион, способные принять пару электронов соединения-донора. Также существует теория Бёрнстведа-Лоури, по которой кислота - это соединение или ион, способные отдать протон основанию или соответствующему химическому веществу.

Классификация кислот и оснований
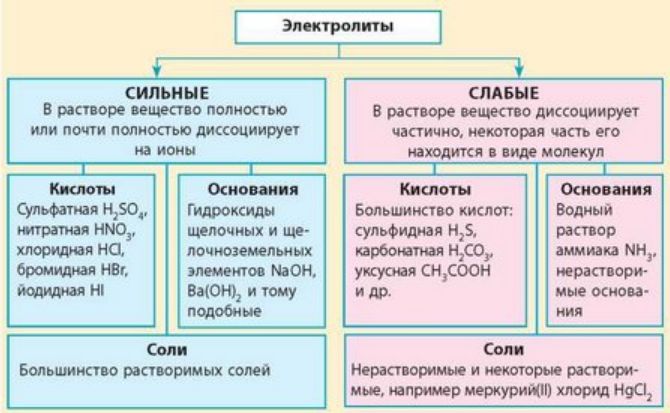
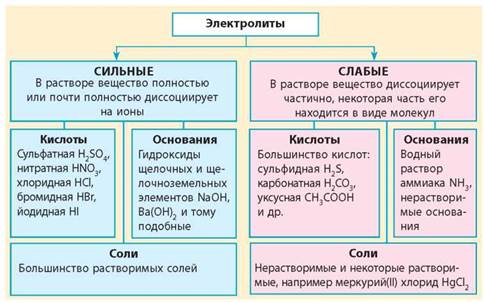
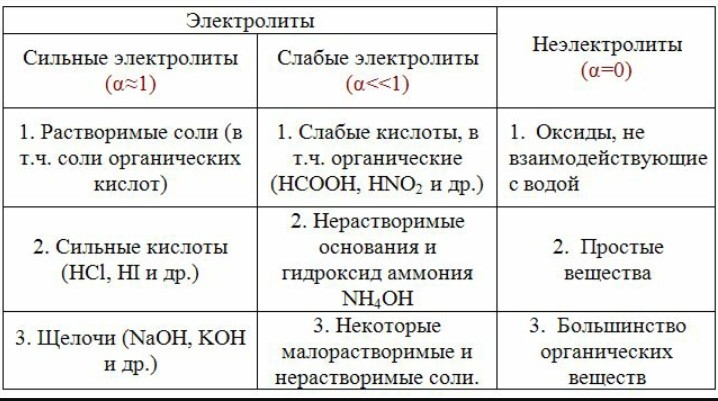
Кислоты могут быть классифицированы на сильные и слабые. Сильные кислоты полностью диссоциируют в воде, образуя катионы водорода и анионы. Примером сильной кислоты является соляная кислота (HCl). Слабые кислоты диссоциируют лишь частично.
Основания - это соединения или ионы, способные отдать пару электронов и образовать ковалентную связь с кислотой. Они также могут быть классифицированы на сильные и слабые. Сильные основания полностью диссоциируют в воде, образуя катионы и анионы. Примером сильного основания является гидроксид натрия (NaOH). Слабые основания диссоциируют лишь частично.

Определение pH раствора
Для определения кислотности или щелочности раствора используется показатель pH. pH - это мера концентрации ионов водорода (H+) в растворе. pH меньше 7 указывает на кислотность раствора, pH больше 7 - на щелочность, а pH равное 7 - на нейтральность.
Существует несколько способов определения pH раствора. Один из них - использование инструмента pH-метра, который трансформирует концентрацию протонов в растворе в электрический сигнал. Другой способ - использование индикаторов, веществ, которые меняют цвет в зависимости от кислотности раствора.
См. также
Взаимодействие кислот и оснований
Кислоты реагируют с основаниями, образуя соль и воду. Это взаимодействие называется реакцией нейтрализации. Например, реакция между соляной кислотой (HCl) и гидроксидом натрия (NaOH) приводит к образованию соли хлорида натрия (NaCl) и воды (H2O).
Кислоты также могут реагировать со солями, вытесняя слабые кислоты из растворов их солей. На выходе получается новая соль и новая кислота. Например, реакция между серной кислотой (H2SO4) и хлоридом бария (BaCl2) приводит к образованию хлорида бария (BaCl2) и соляной кислоты (HCl).
Основания также могут реагировать с солями, образуя новую соль и новое основание. Например, реакция между гидроксидом натрия (NaOH) и хлоридом кальция (CaCl2) приводит к образованию хлорида натрия (NaCl) и гидроксида кальция (Ca(OH)2).

Титрование растворов кислот и оснований
Для количественного определения концентрации кислот и оснований используется титрование. При титровании раствора кислоты раствором основания (алкалиметрия) или раствора основания раствором кислоты (ацидиметрия), определяют точку эквивалентности, при которой эквивалентные количества кислоты и основания реагируют между собой.
Титрование слабых кислот и слабых оснований проводят в неводных растворителях, где их кислотные или основные свойства усиливаются. При титровании слабой кислоты сильным основанием или слабого основания сильной кислотой, pH раствора определяется неполной диссоциацией слабой кислоты, гидролизом соли в точке эквивалентности и буферным действием системы "слабая кислота + соль слабой кислоты".
Кривая титрования слабых кислот и слабых оснований обычно имеет несколько слабых скачков и точка эквивалентности находится при pH>7, если реакция происходит в щелочной зоне, или при pH7, если реакция происходит в кислотной зоне.

Восстановительные свойства кислот
Некоторые кислоты обладают восстановительными свойствами. Например, галогеноводородные кислоты могут быть окислены различными окислителями, такими как диоксид марганца (MnO2), перманганат калия (KMnO4) и дихромат калия (K2Cr2O7), образуя свободные галогены.
Сероводородная кислота может быть окислена диоксидом серы (SO2), образуя серу (S).
См. также
Заключение
Определение сильных и слабых кислот является важным аспектом химии. Сильные кислоты полностью диссоциируют в воде, образуя катионы водорода и анионы, в то время как слабые кислоты диссоциируют лишь частично. Определение pH раствора позволяет определить его кислотность или щелочность. Реакции кислот с основаниями, солями и другими соединениями играют важную роль в химических процессах.
Что нам скажет Википедия?
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией. При количественном определении кислот (алкалиметрия) — рабочим раствором является раствор щелочи NaOH или КОН, при количественном определении щелочи (ацидиметрия) рабочим раствором является раствор сильной кислоты (обычно НСl или H2SO4).
Титрование слабых кислот (pKa>7) и слабых оснований (pKb) ведут в неводных растворителях, в которых их кислотные (основные) свойства усиливаются. В случае слабых кислот это, например, этилендиамин и диметилформамид, в случае слабых оснований - муравьиная кислота и ледяная уксусная кислота.
При титровании слабой одноосновной кислоты сильным основанием/слабого основания сильной кислотой pH раствора определяется как неполной диссоциацией слабой кислоты, гидролизом соли в точке эквивалентности, и буферным действием системы «слабая кислота + соль слабой кислоты». При титровании pH раствора возрастает быстрее, чем при титровании сильной кислоты, скачок pH выражен слабее, а точка эквивалентности находится при pH>7 (в щелочной зоне). Скачок pH тем слабее, чем слабее кислота, меньше её концентрация и выше температура раствора.
При титровании слабого основания сильной кислотой кривая титрования имеет зеркальный вид: pH раствора уменьшается, и точка эквивалентности находится при pH<7.
На поведение pH на кривой титрования влияют несколько ступеней диссоциации кислоты/основания и буферное действие промежуточных солей. На кривой наблюдается несколько слабых скачков титрования.