Кислоты являются краеугольным камнем современной химии. В статье рассматриваются общие и физические свойства кислот, их химические свойства и диссоциация, а также методы определения pH. Узнайте, как определить силу кислот с помощью таблицы Менделеева или справочных материалов.
Cодержание
Общие свойства кислот
Кислоты представляют один из самых распространенных видов химических соединений, вместе с основаниями, солями и металлами. Они являются краеугольным камнем современной химии. Название "кислота" происходит от их кислого вкуса, который был обнаружен средневековыми алхимиками, имеющими привычку пробовать химические соединения. Кислоты состоят из нескольких химических элементов и имеют в своей структуре атомы водорода (H) и кислотный остаток.

Физические свойства кислот
Все кислоты обладают кислым вкусом, однако их физические свойства, такие как цвет, запах и агрегатное состояние, могут варьироваться. Кислоты могут быть твердыми, жидкими или газообразными веществами.

Химические свойства кислот
Химические свойства кислот включают их способность диссоциировать в растворах, образуя катионы водорода (H+). Кислоты могут реагировать с основаниями и образовывать новые вещества.
Диссоциация кислот
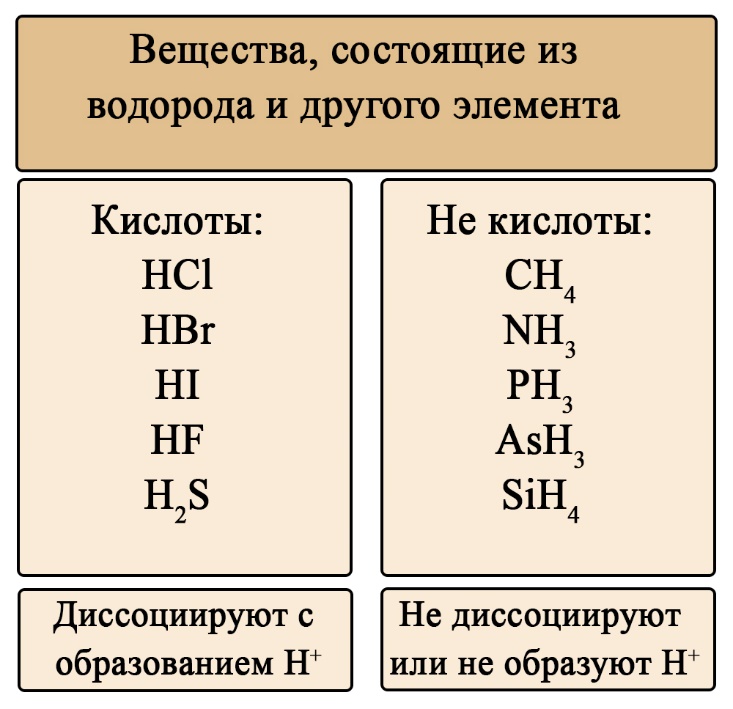
Диссоциация - это процесс распада вещества на ионы в растворах или расплавах. Например, соляная кислота (HCl) диссоциирует на ионы водорода (H+) и хлоридные ионы (Cl-). Кислоты можно классифицировать на основе их способности возможной диссоциации.
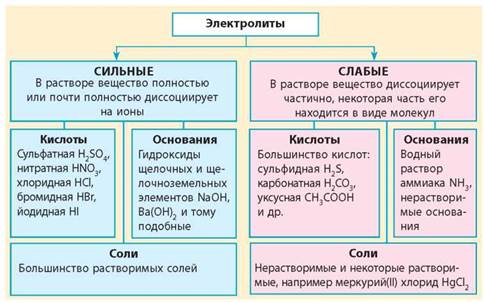
Сильные кислоты
Сильные кислоты полностью диссоциируют в воде, образуя катионы водорода (H+) и соответствующие анионы. Примером сильной кислоты является соляная кислота (HCl).
Слабые кислоты
Слабые кислоты диссоциируют только частично в воде, оставаясь в основном в молекулярной форме. Примером слабой кислоты является уксусная кислота (CH3COOH).
См. также
Определение силы кислот
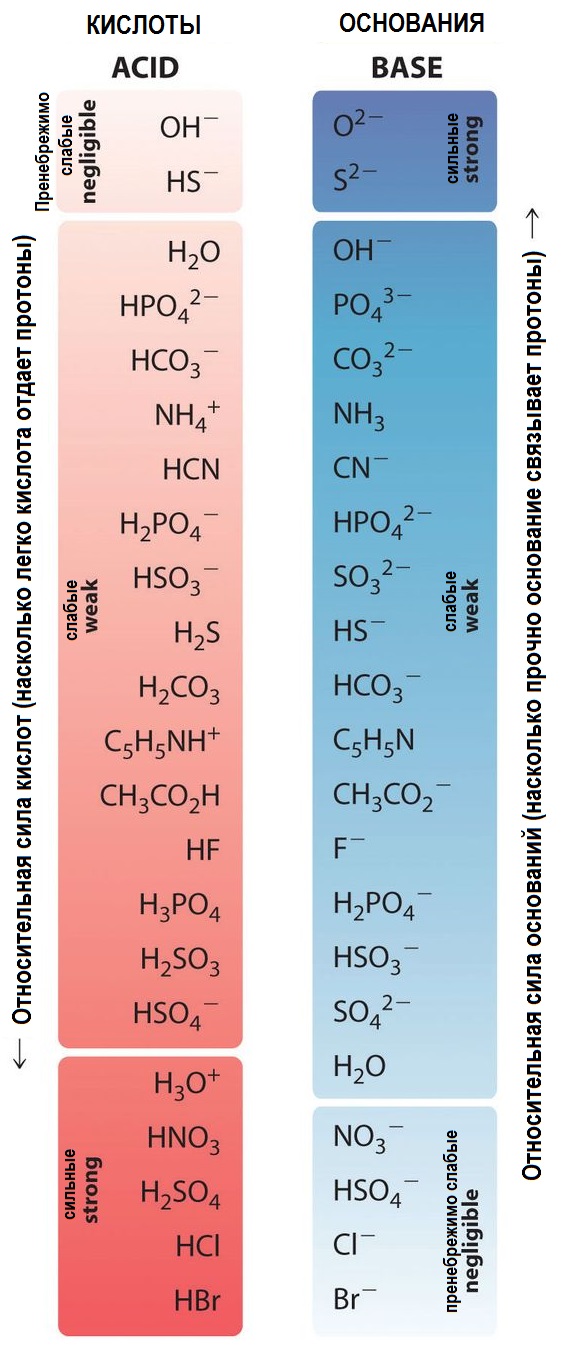
Сила кислоты зависит от скорости отдачи протона водорода при диссоциации. Сильные кислоты отдают протон водорода быстро, в то время как слабые кислоты отдают протон водорода медленно. Силу кислот можно определить с помощью таблицы Менделеева или справочных материалов.
Классификация кислот по основности
Кислоты могут быть одноосновными, двухосновными или многоосновными, в зависимости от количества протонов водорода, которые они могут отдать. Например, соляная кислота (HCl) является одноосновной, а фосфорная кислота (H3PO4) является трехосновной.

Методы определения pH
pH - это мера кислотности или щелочности раствора. Определение pH может быть выполнено с помощью инструментальных методов, таких как использование pH-метра, который преобразует концентрацию протонов в растворе в электрический сигнал. Также можно использовать индикаторы, которые изменяют цвет в зависимости от pH раствора.
Сильные и слабые кислоты в определении pH
Сильные кислоты имеют низкий pH, близкий к 0, так как они полностью диссоциируют и образуют большое количество ионов водорода. Слабые кислоты имеют более высокий pH, близкий к 7, так как они диссоциируют только частично и образуют меньшее количество ионов водорода.