Узнайте, что такое ряд электроотрицательности и почему это важно в химии. Электроотрицательность определяет тип связей и другие химические свойства веществ.
Cодержание
Электроотрицательность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов притягивать к себе электроны других атомов. Электроотрицательность играет важную роль в химии, так как определяет тип связей, распределение заряда и другие химические свойства веществ.
История и концепция электроотрицательности
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
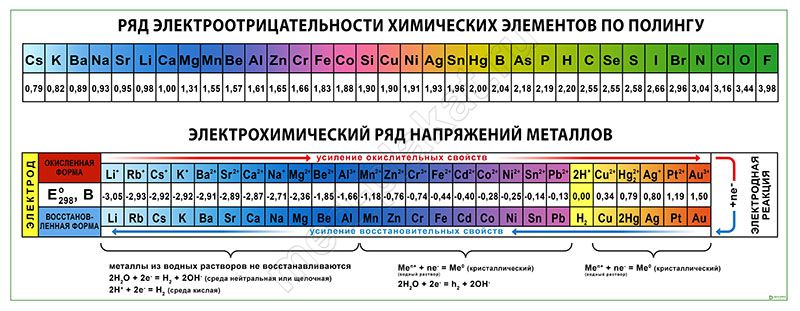
Первая и наиболее широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор считается наиболее электроотрицательным элементом, за ним следуют кислород, азот и хлор. Низкую степень электроотрицательности имеют активные металлы.
Строго говоря, электроотрицательность не является постоянной величиной и зависит от многих факторов, таких как валентное состояние атома, степень окисления, тип соединения и другие. Для определения электроотрицательности атомов используются различные методы, результаты которых в целом согласуются друг с другом.

Шкалы электроотрицательности
Существует несколько различных шкал электроотрицательности, в основе которых лежат разные свойства веществ. Однако относительное расположение элементов в этих шкалах примерно одинаково. Наиболее известной и широко используемой шкалой является шкала Полинга, где наивысшее значение электроотрицательности принадлежит фтору (4,0), а наименьшее - францию (0,7).
См. также
Значение электроотрицательности для химических связей
Электроотрицательность играет важную роль в определении типа химических связей. Если разность электроотрицательностей двух атомов в молекуле велика, то образуется полярная ковалентная связь, где электроны неодинаково делятся между атомами. Если разность электроотрицательностей невелика, то образуется неполярная ковалентная связь, где электроны равномерно распределены между атомами.

Значение электроотрицательности для химических свойств элементов
Электроотрицательность также определяет некоторые химические свойства элементов. Неметаллы, у которых электроотрицательность выше двух, обладают более выраженными неметаллическими свойствами. Металлы, у которых электроотрицательность меньше двух, обладают более выраженными металлическими свойствами. Элементы с высокой и низкой электроотрицательностью считаются активными.

Заключение
Ряд электроотрицательности является важным инструментом для понимания и описания химических свойств элементов и химических связей в молекулах. Шкалы электроотрицательности помогают нам определить, в какую сторону смещаются электроны в молекулах и как это влияет на их химические свойства. Электроотрицательность является ключевым параметром в химии и позволяет нам более глубоко понять и объяснить различные явления и процессы в мире веществ.
См. также
Что нам скажет Википедия?
Электроотрицательность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов притягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов, F, O, N, Cl), а низкая — у активных металлов (s-элементов I группы, Na, K, Cs).
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,2. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы. Помимо шкалы Малликена, описанной выше, существует более 20 различных других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.