Узнайте, какие вещества можно растворить в серной кислоте и какие свойства у нее. История получения, химические свойства и применение серной кислоты.
Cодержание
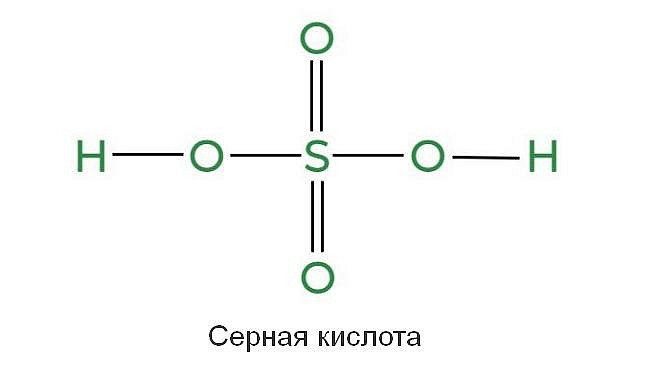
Серная кислота (H2SO4) является сильной неорганической кислотой с высшей степенью окисления серы (+6). При обычных условиях она представляет собой тяжелую маслянистую жидкость без цвета и запаха, с сильнокислым «медным» вкусом. В технике серной кислотой называют как ее водные растворы, так и смеси с серным ангидридом SO3, которая называется олеумом.

Исторические сведения и получение
Серная кислота известна с древности и встречается в природе в виде озер вблизи вулканов. Первые упоминания о кислых газах, получаемых при прокаливании квасцов или железного купороса, встречаются в сочинениях арабского алхимика Джабира ибн Хайяна. В IX веке персидский алхимик Ар-Рази и европейский алхимик Альберт Магнус разработали способы получения серной кислоты из различных сырьевых материалов.
На протяжении XVIII—XIX веков серная кислота получалась из серного колчедана (пирита) на купоросных заводах. В то время ее называли «купоросным маслом», что стало основой для названия ее солей - купоросов. Серная кислота также получалась из пирита, который был более дешевым и распространенным сырьем, чем сера. С развитием катализа, в настоящее время серную кислоту получают каталитическим окислением оксида серы на V2O5.

Характеристики и свойства
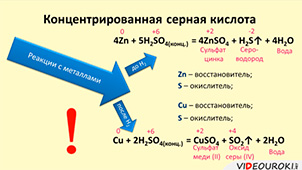
Серная кислота обладает сильными окислительными свойствами и считается мощным окислителем. Она образовывает кислые (бисульфаты) и средние (сульфаты) соли. Главное свойство серной кислоты - гигроскопичность, она легко взаимодействует с водой независимо от пропорций. Ее температура кипения зависит от концентрации, при 98%-ой концентрации достигает максимума 330 °C. Температура плавления составляет 10,38 °C, а плотность - 1,84 г/см3.
Серная кислота взаимодействует с многими элементами и соединениями. Она окисляет большинство металлов, находящихся в электрохимическом ряду активности левее водорода. Однако платина и золото не подвержены окислению серной кислотой. Также серная кислота способна растворять серный ангидрид (SO3), образуя олеум.
См. также
Классификация и разбавление
Серная кислота с концентрацией выше 40% называется концентрированной. Она обладает окислительными свойствами и растворяет серебро и палладий. Разбавленные растворы содержат концентрацию до 40% и могут взаимодействовать с медью и латунью. Для преобразования концентрированной серной кислоты в разбавленную, ее нужно смешать с водой, соблюдая осторожность.

Олеум
Растворы серного ангидрида (SO3) в серной кислоте называются олеумом. Он образуется при реакции серной кислоты с SO3 и образует два соединения: H2SO4·SO3 и H2SO4·2SO3. Температура кипения водных растворов серной кислоты повышается с ростом концентрации, а температура кипения олеума понижается с увеличением содержания SO3.
Содержание серной кислоты в парах над водными растворами зависит от их концентрации. При нагревании водных растворов до 70% концентрации, пары не содержат серную кислоту. Однако при концентрации 95%, пары преимущественно состоят из серной кислоты.

Заключение
Серная кислота, являясь сильной неорганической кислотой, имеет широкий спектр применений в различных отраслях промышленности. Она играет важную роль в производстве лекарственных препаратов, удобрений, химической продукции и средств очищения нефтепродуктов. Знание ее свойств и возможностей растворения помогает в разработке новых технологий и применении в различных процессах.
См. также
Что нам скажет Википедия?
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, образующиеся по реакциям:
Реакция Продукт H2SO4 + SO3 H2SO4·SO3 H2SO4 + 2SO3 H2SO4·2SO3 Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3% H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3% H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
ln P = A - B/(T + C)
Величины коэффициентов A и B зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
В парах водных растворов серной кислоты при концентрации до 70% при нагревании не наблюдается сама серная кислота. При концентрации выше 70% количество серной кислоты в парах растет экспоненциально. Так, при 80% концентрация H2SO4 в парах составляет около 5%, при 85% около 10%, при концентрации в 90% около 20%, но при 95% пар преимущественно представляет собой серную кислоту (все данные представлены в массовом отношении).