Алкогольдегидрогеназа (алкоголь: НАД⁺-оксидоредуктаза, КФ 1.1.1.1) является ферментом класса дегидрогеназ, который катализирует окисление спиртов и ацеталей до альдегидов и кетонов в присутствии никотинамидадениндинуклеотида (НАД). Этот фермент является специфическим для клеток печени и его активность может указывать на повреждение клеток печени. Узнайте больше о функциях, механизмах действия и распространении алкогольдегидрогеназы в данной статье.
Cодержание
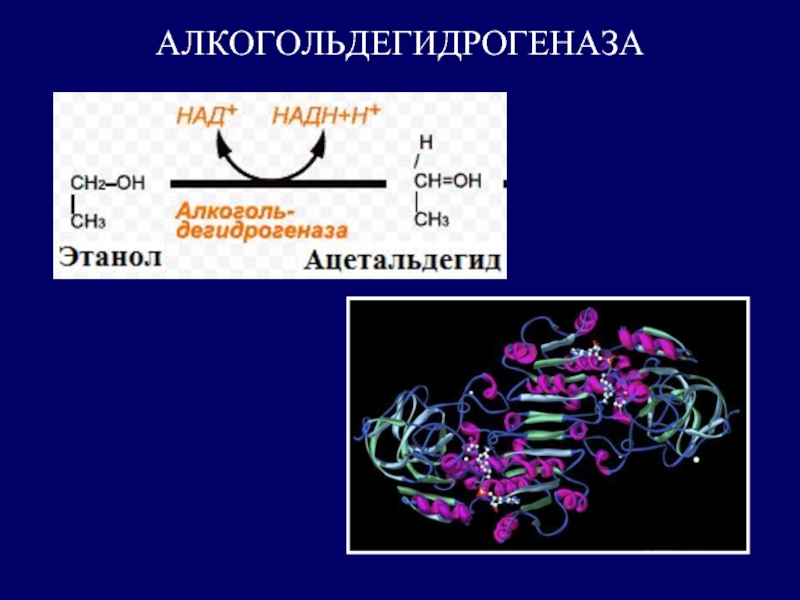
Алкогольдегидрогеназа (алкоголь: НАД⁺-оксидоредуктаза, КФ 1.1.1.1) — фермент класса дегидрогеназ, катализирующий окисление спиртов и ацеталей до альдегидов и кетонов в присутствии никотинамидадениндинуклеотида (НАД). Алкогольдегидрогеназы (алкоголь: НАД⁺-оксидоредуктазы) являются димерами, состоящими из субъединиц с молекулярным весом около 40 000 и содержащими ион цинка Zn2+.

Функции
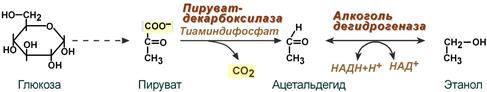
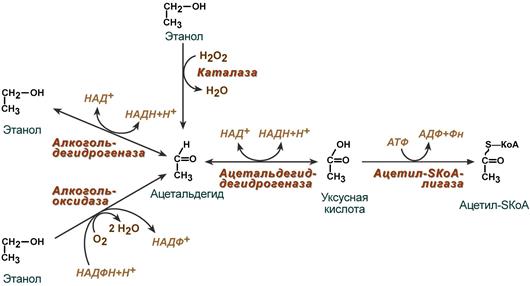
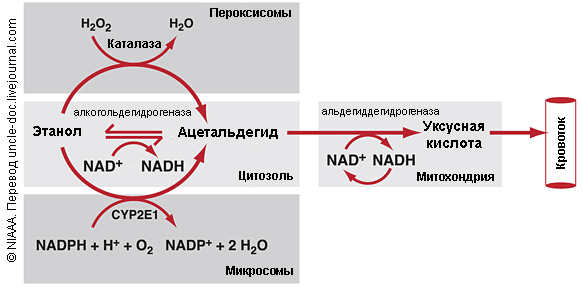
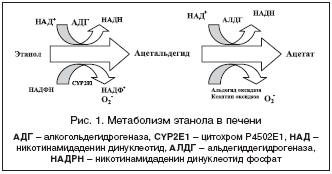
Алкогольдегидрогеназа катализирует реакцию:
этанол + НАД+ ⇌ ацетальдегид + НАДН + H+.
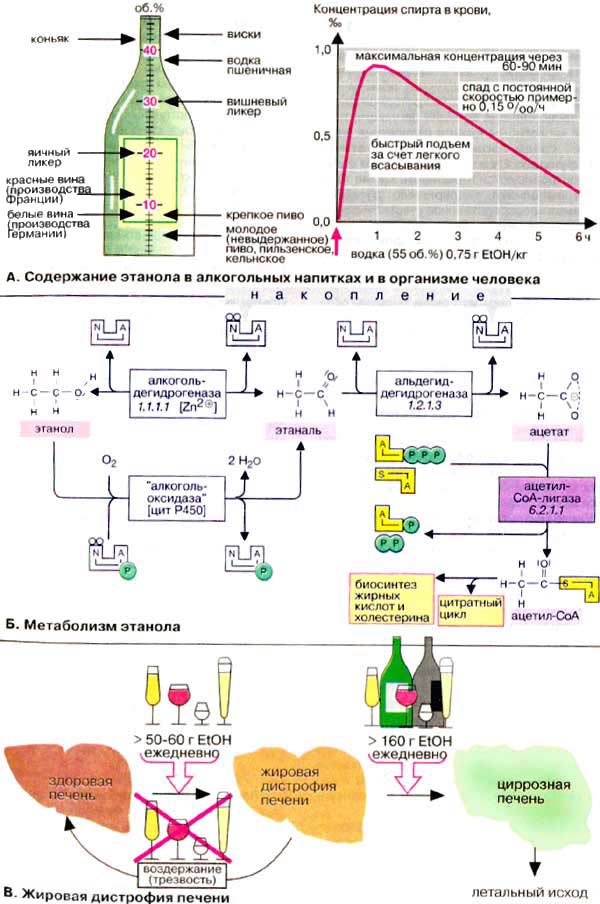
Этот фермент является специфическим для клеток печени. Появление его в сыворотке крови свидетельствует о повреждении клеток печени. Резкое повышение содержания фермента наблюдается при острых гепатитах, при этом его показатели приходят к норме раньше, чем показатели трансаминаз. Однако при обтурационной желтухе, циррозах печени, инфаркте миокарда и мышечной дистрофии Эрба обычно не наблюдается повышения активности фермента в крови.
Механизмы действия
Оптимальная активность алкогольдегидрогеназы наблюдается при pH 8,0. Действие фермента тормозят цианиды и йодоацетат.
См. также
Распространение
Фермент алкогольдегидрогеназа находится в больших количествах только в печени, но в небольшом количестве присутствует также в почках. Следы фермента обнаруживаются в сердечной и скелетной мускулатуре человека. В сыворотке крови здорового человека алкогольдегидрогеназа отсутствует.

Активность в организме
Активность алкогольдегидрогеназы в организме человека зависит от возраста, пола, этнической принадлежности и генетической предрасположенности. Например, молодые женщины не могут обрабатывать алкоголь с той же скоростью, что и молодые мужчины, потому что они не экспрессируют алкогольдегидрогеназу так же высоко. Однако это не верно для среднего возраста. С ростом частоты и регулярности употребления алкоголя активность алкогольдегидрогеназы снижается.

Фармакогенетика алкогольдегидрогеназы
Алкогольдегидрогеназа (АДГ) представлена различными формами. Известны их субстраты, которые помимо этанола и других алифатических спиртов включают 4-гидроксиноненаль, альдегиды, полученные перекисным окислением липидов, стероиды, гидроксилированные жирные кислоты и промежуточные соединения медиаторных путей в процессе образования ретиноевой кислоты из витамина А.
Класс I (ADH1)
Ферменты этого класса обладают этанол-окислительной активностью. Гены трех типов ADH1A, ADH1B и ADH1C кодируют α-, β- и γ-субъединицы, которые могут образовывать гомо- и гетеродимеры, ответственные за большую часть окислительной активности печени по отношению к этанолу. Исследования продемонстрировали меньший риск стать алкоголиком для азиатов.
Метод исследования
Для исследования полиморфизма длин рестрикционных фрагментов можно использовать венозную кровь или буккальный (щечный) эпителий.
Название гена - ADH1C
OMIM - *103730
Локализация гена на хромосоме - 4q23
Функция гена - ген ADH1C кодирует гамма-субъединицу белка алкогольдегидрогеназы (ADH), который участвует в метаболизме этанола и окисляет его до ацетальдегида. Белок ADH наиболее активен в печени и почках взрослых людей.
Генетический маркер A1048G
Генетический маркер A1048G представляет замену азотистого основания аденина на гуанин в позиции 1048 последовательности гена ADH1C. Эта замена приводит к изменению биохимических свойств фермента, где аминокислота изолейцин замещается на валин.
Также известна замена аминокислоты изолейцина на валин в белке в позиции 349, обозначаемая как Ile349Val.
Возможные генотипы
Встречаемость минорного аллеля в европейской популяции составляет 42%.
Общая информация об исследовании
В метаболизме алкоголя участвуют два основных фермента: алкогольдегидрогеназа и альдегиддегидрогеназа. Они обрабатывают этанол, превращая его в ацетальдегид и затем в ацетат. Работа этих ферментов и скорость их метаболизма зависят от генетических вариантов, кодирующих эти ферменты.
Алкоголь (этиловый спирт) является токсичным соединением, и его употребление негативно сказывается на здоровье. Однако некоторые исследования позволяют предположить пользу умеренного потребления, например, красного вина. Важно понимать, что метаболизм алкоголя в организме каждого человека индивидуален.
Белок алкогольдегидрогеназа (ADH) состоит из альфа-, бета- и гамма-субъединиц, которые кодируются соответствующими генами. Ген ADH1C, локализованный на 4-й хромосоме, кодирует гамма-субъединицу алкогольдегидрогеназы.
Можно ли повлиять на выработку фермента? На данный момент не существует методов, позволяющих контролировать и влиять на выработку и скорость действия алкогольдегидрогеназы. Исследования в этой области проводились, но пока медицина не может на достаточном уровне управлять биохимическими процессами в организме человека.
Для предупреждения проблем с алкоголем важно обращаться к ним на ранней стадии. Можно сдать анализы на определение видов алкогольдегидрогеназы и ацетальдегидрогеназы, выработанных организмом. Также стоит узнать допустимую дозу алкоголя для себя, которая рассчитывается с учетом возраста, пола, веса и других факторов.
Обратившись в нашу клинику, вы сможете сдать соответствующие анализы и получить консультацию у квалифицированного специалиста. Если вы уже столкнулись с проблемой алкогольной зависимости, наши специалисты помогут вам с индивидуальным курсом лечения алкоголизма и помогут преодолеть эту пагубную привычку.
См. также
Что нам скажет Википедия?
Алкогольдегидрогеназа (алкоголь: НАД⁺-оксидоредуктаза, КФ 1.1.1.1) — фермент класса дегидрогеназ, катализирующий окисление спиртов и ацеталей до альдегидов и кетонов в присутствии никотинамидадениндинуклеотида (НАД). Алкогольдегидрогеназы (алкоголь: НАД⁺-оксидоредуктазы) являются димерами, состоящими из субъединиц с молекулярным весом около 40 000 и содержащими ион цинка Zn2+.
Катализирует реакцию: этанол + НАД+ ⇌ ацетальдегид + НАДН + H+.
Является специфическим для клеток печени. Появление его в сыворотке крови свидетельствует о повреждении клеток печени. Резкое повышение содержания фермента наблюдается при острых гепатитах (при этом его показатели приходят к норме раньше, чем показатели трансаминаз). При обтурационной желтухе, циррозах печени, инфаркте миокарда, мышечной дистрофии Эрба обычно не наблюдается повышения активности фермента в крови.
Оптимум действия фермента находится при pH 8,0. Цианиды, йодоацетат тормозят действие энзима.
В больших количествах фермент находится лишь в печени, но небольшое количество также содержат почки. Следы фермента также обнаруживаются в сердечной и скелетной мускулатуре человека. В сыворотке крови здорового человека отсутствует.
Активность алкогольдегидрогеназы в организме человека зависит от возраста, пола, этнической принадлежности, генетической предрасположенности. Например, молодые женщины не могут обрабатывать алкоголь с той же скоростью, что и молодые мужчины, потому что они не экспрессируют алкогольдегидрогеназу так же высоко, хотя обратное верно для среднего возраста. С ростом частоты и регулярности употребления алкоголя активность алкогольдегидрогеназы снижается.
Алкогольдегидрогеназа (АДГ) — фермент, представленный различными формами. Были охарактеризованы 5 классов АДГ. Их фармакогенетика не была широко изучена, но хорошо известны их субстраты: кроме этанола и других алифатических спиртов, включает 4-гидроксиноненаль, альдегиды, полученные перекисным окислением липидов, стероиды, гидроксилированные жирные кислоты, промежуточные соединения медиаторных путей в процессе образования ретиноевой кислоты из витамина А.
Обладают этанол-окислительной активностью. Гены трех типов ADH1A, ADH1B и ADH1C кодируют α-, β- и γ-субъединицы, которые могут образовывать гомо- и гетеродимеры, которые ответственны за большую часть окислительной активности печени по отношению к этанолу. Некоторые исследования продемонстрировали меньший риск стать алкоголиком для азиатов с наличием ADH1B2 аллеля (частота 60—80 % в азиатских популяциях и около 4 % в безалкогольных европейских популяциях). Также некоторые исследования указывают на распространение аллеля ADH1C1 среди безалкогольной популяции.
Высоко консервативны, активны по отношению к глутатион-конъюгированному формальдегиду, а также к глутатион-NO и к свободным гидроксилированным жирным кислотам и лейкотриенам. Ферменты класса III участвуют в пути ликвидации формальдегида и имеют древнее происхождение от прокариот, но, несмотря на это, формы фермента АДГ3 варьируются незначительно.
Обладают ретинол-дегидрогеназной активностью, участвуют в формировании ретиноевой кислоты и, следовательно, в регуляции дифференцировки клеток позвоночных.
На основании кинетических свойств различных вариантов и предполагаемого содержания фермента АДГ в печени, исследователи рассчитали вклад различных ферментов АДГ на способность печени окислять этанол. Для человека (средний вес которого 70 кг), у которого концентрация этанола в крови приблизительно 100 мг/100 мл, если он гомозиготен по ADH1B1 и ADH1C1 ферменты класса I окисляют 70 % этанола. Для человека гомозиготного по ADH1B1 и ADH1C2 окислительная способность составляет 80 %. Присутствие ADH1C2 аллели будет связано со слегка пониженной окислительной способностью, в то время как наличие adh1b2 и adh1b3 аллели было бы связано с существенно более высокой окислительной способностью (то есть более быстрое окисление этанола в ацетальдегид). Эти расчеты приближены, так как не учитывают размер печени и различия экспрессии генов.
Гены ADH1B и ALDH2 (ген, кодирующий одного из представителей семейства альдегиддегидрогиназ) являются наиболее сильно связаны с риском развития алкоголизма. Они способны уменьшить риск алкоголизма путем увеличения локальных уровней ацетальдегида, либо за счет быстрого окисления этанола, либо за счет медленного окисления ацетальдегида. Точный баланс между скоростями окисления этанола и ацетальдегида может иметь решающее значение при определении концентрации ацетальдегида в клетках, таким образом, что небольшие различия в относительной активности ADG и ALDH могут вызвать значительные различия в концентрации ацетальдегида).
Семейство ферментов алкогольдегидрогеназ (АДГ) может принимать участие в метаболизме ретинола (витамина А), а также в метаболизме этанола. Некоторые члены семейства АДГ предпочитают ретинол в качестве субстрата вместо этанола, и их способность окислять ретинол конкурентно ингибируется высокими концентрациями этанола. Кроме того, существует семейство альдегиддегидрогеназ (ALDH), содержащее несколько представителей, предпочитающих ретиналь в качестве субстрата вместо ацетальдегида.
Как показано с помощью рентгеновской кристаллографии, в печени лошади алкогольдегидрогеназа претерпевает глобальные конформационные изменения при связывании НАД+ или НАДН, включающие поворот каталитического домена относительно кофермент-связывающего домена и перестройку активного сайта для получения каталитически-активного фермента. Изменение конформации требует полного кофермента и зависит от различных химических или мутационных замен, которые могут увеличить каталитическую активность за счет изменения кинетики изомеризации и скорости диссоциации коферментов.